Parodontitis zählt zu den häufigsten chronischen Erkrankungen und erhöht das Risiko für systemische Krankheiten. Ein neuer Ansatz hemmt gezielt die Virulenz von P. gingivalis, ohne das Mikrobiom zu zerstören – ein vielversprechender Fortschritt in der Prävention und Behandlung.
Die Mundhöhle beherbergt ein komplexes Mikrobiom mit über 700 verschiedenen Bakterienarten, die essenziell für die Mundgesundheit sind und zusammen analog zum Darmmikrobiom in einer Eubiose wirken [1]. Parodontitis, eine bakteriell verursachte Entzündung des Zahnhalteapparates, ist eine der häufigsten Erkrankungen weltweit: Studien zeigen, dass global jeder zehnte Mensch an einer Parodontitis leidet [2]. Diese chronische Entzündung birgt nicht nur Risiken für den Verlust von Zähnen, sondern erhöht auch die Wahrscheinlichkeit systemischer Erkrankungen wie Krebs, Herz-Kreislauf-Erkrankungen, rheumatoide Arthritis und Diabetes, ja selbst für die Alzheimer’sche Erkrankung gibt es mittlerweile sehr deutliche Hinweise über eine Assoziation mit Parodontitis [3].
Die Rolle von P. gingivalis in der Pathogenese
Einer der Hauptakteure bei der Entstehung von Parodontitis ist das gramnegative Bakterium Porphyromonas gingivalis. Es wird häufig als sogenanntes Key-Stone-Pathogen bezeichnet und manipuliert das orale Mikrobiom und das Immunsystem. Damit hält es die lokale Entzündung in Gang, die dann wiederum zum Gewebeabbau bei Zahnfleisch und Knochen führt [4]. Dies geschieht unter anderem durch sogenannte Virulenzfaktoren des Bakteriums wie zum Beispiel Gingipaine, die unter anderem die Immunantwort hemmen und Gewebeschäden fördern. Es findet also eine Änderung von der Eubiose hin zu einer Dysbiose im oralen Mikrobiom statt. Die Folge ist ein Teufelskreis aus Entzündung und Gewebezerstörung [5].
Grenzen der bisherigen Behandlungsmethoden
Die derzeitige Standardbehandlung der Parodontitis analog zur S3-Richtlinie umfasst die mechanische Entfernung des bakteriellen Biofilms sowie Desinfektionsmaßnahmen. Weiterhin werden bei Bedarf lokale und auch systemische Antibiotikatherapien empfohlen. Diese Ansätze sind oft schmerzhaft, erfordern eine regelmäßig wiederkehrende unterstützende Parodontitistherapie (UPT) [6]. Gerade die systemische Antibiotikagabe ist oft von Nebenwirkungen begleitet und es besteht die Gefahr der Resistenzbildung gegenüber wertvollen Wirkstoffen. Durch die angewendeten Therapien wird das orale Mikrobiom vollständig „zurückgesetzt”, der anschließende Wettlauf aufgrund der stattfindenden bakteriellen Rekolonisation begünstigt oftmals die pathogenen Keime – ein Teufelskreis entsteht [7].
Ein innovativer Ansatz: Selektive Hemmung statt Zerstörung
Was wäre jedoch, wenn man gezielt bereits im Vorfeld die Virulenz wichtiger Keime und damit die Ausbildung einer Dysbiose verhindern könnte? Ein solch vielversprechender neuer Ansatz setzt direkt bei P. gingivalis an: Die von PerioTrap Pharmaceuticals, einer Ausgründung aus dem Fraunhofer IZI-MWT in Halle (Saale), entwickelte Technologie zielt darauf ab, die Reifung der Virulenzfaktoren dieses Bakteriums gezielt zu verhindern, ohne es jedoch abzutöten [8]. Dadurch wird die Entstehung von Resistenzen stark vermindert. Aufwendige Experimente haben gezeigt, dass dieser innovative Inhaltsstoff die Invasion von P. gingivalis in Keratinozyten sowie die Bindung des Bakteriums an rote Blutkörperchen unterbindet. Auch in komplexen Biofilmen kam es zu einer Verminderung der Virulenz von P. gingivalis. Gleichzeitig blieb die Gesamtzahl aller Bakterien, inklusive von P. gingivalis, im gemischten Biofilm unverändert, was dafürspricht, dass das Pathogen selbst nicht abgetötet wird. Außerdem konnte gezeigt werden, dass der Inhaltsstoff kommensale („harmlose“) Bakterien nicht beeinflusst.
Diskussion auf der
EuroPerio 2025
Die neue Technologie von PerioTrap wurde erstmals auf der IDS 2025 in Köln präsentiert und fand großen Anklang bei Fachbesuchern. Am Messestand wurden intensive Gespräche mit Zahnärzten, Dentalhygieniker:innen und zahnmedizinischen Prophylaxeassistent:innen geführt, die insgesamt ein sehr positives Feedback lieferten. Diese Diskussionen sollen auf der EuroPerio 2025 in Wien (14. – 17. Mai 2025) fortgesetzt werden, wo PerioTrap ihren innovativen Ansatz erneut einem spezialisierten Fachpublikum an einem eigenen Stand vorstellt. Der wissenschaftliche Austausch bietet eine wertvolle Möglichkeit, das Potenzial der Technologie für die zukünftige Prävention von Parodontitis weiter zu analysieren und zu fördern. Mit diesem gezielten Ansatz könnte ein Paradigmenwechsel in der Parodontitis-Vorsorge eingeleitet werden – hin zu einer ganzheitlichen Pflege, die das Gleichgewicht des oralen Mikrobioms wahrt und gleichzeitig pathogene Prozesse in Richtung Karies und Parodontitis effektiv unterbindet.
Anwendung in neuen Produkten
Der Inhaltsstoff findet Anwendung in zwei neuen Produkten: dem orazen Zahnpflegegel für den professionellen Einsatz nach der PZR und der orazen Mikrobiom-Zahnpasta für die tägliche Zahnpflege. Beide Produkte kombinieren den innovativen Inhaltsstoff mit Fluorid und weiteren pflegenden Komponenten, um eine ganzheitliche Vorsorge gegen Karies und Parodontitis zu gewährleisten. Weitere Informationen unter www.periotrap.com und
www.orazen.de.
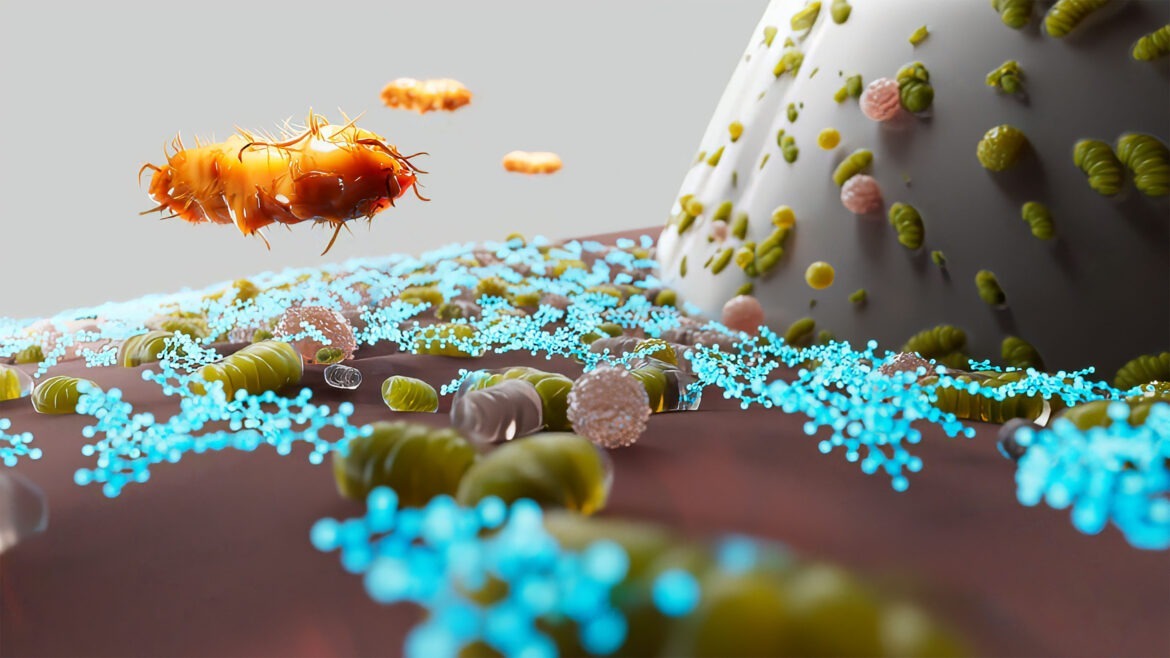
Titelbild: Porphyromonas gingivalis bei der Kolonisation des Zahnfleischs – gezielt gehemmt durch den neuen Inhaltsstoff
Quellen:
[1] Abdulkareem, A.A.; Al-Taweel, F.B.; Al-Sharqi, A.J.B.; Gul, S.S.; Sha, A.; Chapple, I.L.C. Current Concepts in the Pathogenesis of Periodontitis: From Symbiosis to Dysbiosis. J Oral Microbiol 2023, 15, 2197779, doi:10.1080/20002297.2023.2197779.
[2] Botelho, J.; Machado, V.; Leira, Y.; Proença, L.; Chambrone, L.; Mendes, J.J. Economic Burden of Periodontitis in the United States and Europe: An Updated Estimation. J. Periodontol. 2022, 93, 373–379, doi:10.1002/jper.21-0111.
[3] Huang, D.; Wang, Y.-Y.; Li, B.-H.; Wu, L.; Xie, W.-Z.; Zhou, X.; Ma, B. Association between Periodontal Disease and Systemic Diseases: A Cross-Sectional Analysis of Current Evidence. Mil. Méd. Res. 2024, 11, 74, doi:10.1186/s40779-024-00583-y.
[4] Hajishengallis, G.; Diaz, P.I. Porphyromonas Gingivalis: Immune Subversion Activities and Role in Periodontal Dysbiosis. Curr Oral Heal Reports 2020, 7, 12–21, doi:10.1007/s40496-020-00249-3.
[5] Belibasakis, G.N.; Belstrøm, D.; Eick, S.; Gursoy, U.K.; Johansson, A.; Könönen, E. Periodontal Microbiology and Microbial Etiology of Periodontal Diseases: Historical Concepts and Contemporary Perspectives. Periodontol 2000 2023, doi:10.1111/prd.12473.
[6] Sanz, M.; Herrera, D.; Kebschull, M.; Chapple, I.; Jepsen, S.; Berglundh, T.; Sculean, A.; Tonetti, M.S.; Consultants, E.W.P. and M.; Aass, A.M.; et al. Treatment of Stage I–III Periodontitis—The EFP S3 Level Clinical Practice Guideline. J Clin Periodontol 2020, 47, 4–60, doi:10.1111/jcpe.13290.
[7] Brookes, Z.; Teoh, L.; Cieplik, F.; Kumar, P. Mouthwash Effects on the Oral Microbiome: Are They Good, Bad, or Balanced? Int. Dent. J. 2023, 73, S74–S81, doi:10.1016/j.identj.2023.08.010.
[8] Taudte, N.; Linnert, M.; Rahfeld, J.-U.; Piechotta, A.; Ramsbeck, D.; Buchholz, M.; Kolenko, P.; Parthier, C.; Houston, J.A.; Veillard, F.; et al. Mammalian-like Type II Glutaminyl Cyclases in Porphyromonas Gingivalis and Other Oral Pathogenic Bacteria as Targets for Treatment of Periodontitis. J. Biol. Chem. 2021, 296, 100263, doi:10.1016/j.jbc.2021.100263.







KEINE KOMMENTARE